猴痘检测试剂盒美国EUA申报资料要求简述
来源: 发布时间:2022-11-15
猴痘检测试剂盒EUA出台背景:
由于今年猴痘病毒在全球范围内的迅速扩张和兴起,2022年8月9日,美国卫生与公众服务部(HHS)将猴痘病毒的在海外美国公民的感染以及对国家健康安全造成重大潜在隐患的这一现象归为公众健康危机事件;基于该决定,FDA于2022年9月7日宣布对用于检测或者诊断猴痘病毒感染的体外诊断试剂启动授权紧急使用(EUA)。

猴痘检测试剂盒EUA适用范围:
目前猴痘试剂的EUA模板只针对分子诊断,其他类型的诊断(抗原,抗体)的暂时还没有出台。
猴痘检测试剂盒EUA申报资料要求简述
根据FDA于2022年9月7日发布的《应对突发公共卫生事件的猴痘检测政策》以及针对两份猴痘检测试剂盒EUA的模板,以下我们精心整理出了该EUA下需要提供的制造信息和性能评估的要求:
制造信息要求:
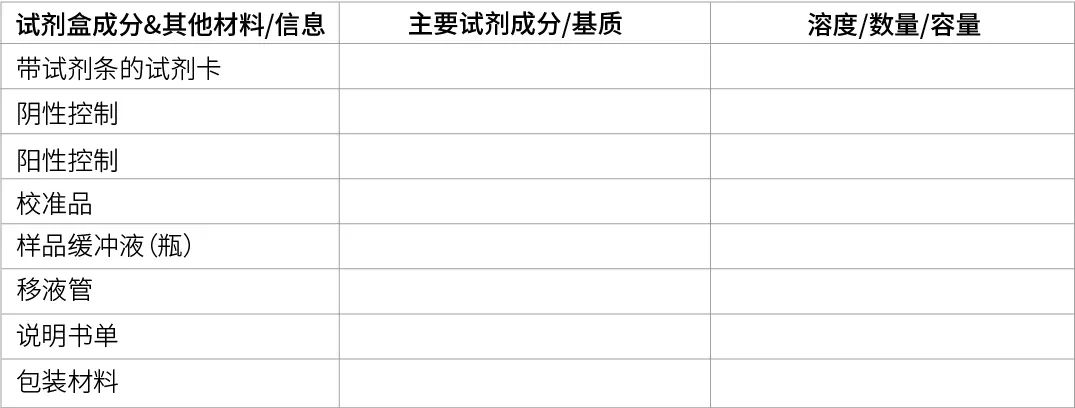
1. 产品成分描述
描述包含在测试中的所有成分
举例:试剂盒成分&其他原材料/信息表
猴痘试剂对应仪器描述
(1)若仪器不是制造商生产的,那制造商需要提供:
说明书中适当的程序描述,包括允收标准,客户应在使用试剂前根随允收标准来评估设备的性能;
在设备通过审核后需要贴上一个“仅用于紧急授权使用”的标签;
确保试剂标签要么复制仪器操作手册中与运行测试相关的部分,要么引用手册中的相关章
(2)若仪器是制造商生产的,那制造商需要提供:
生产仪器工厂的质量方案或者ISO 13485证书;
一份标注制造商符合下列21 CFR part 820法规章节的文件:
H(接收活动,21 CFR 820.80, 21 CFR 820.86); I(不合格品,21 CFR 820.90);O(数据技术,21 CFR 820.250)
在设备通过审核后需要贴上一个“仅用于紧急授权使用”的标签;
仪器操作手册附录,包含FDA建议的相关信息。
2.猴痘测试仪器的软件要求
1.软件的关注等级(主要,始终,微小)
2.软件确认阶段
若软件确认还未完成,未来软件确认的文件的递交将成为获批EUA的条件
若软件确认已经完成,提供所有的测试方案和报告,包括系统软件功能的描述;支持试剂测试预期用途的设备技术要求并提供支持性的证据。
若器械软件包含任何外部链接或者无线连接端口(例如USB,SD,CD,RGA,Wi-Fi,蓝牙,云端等),需要提供网络安全报告以确保使用者和用户在预期使用环境中的安全性。
3.基本安全和性能要求
测试中的带电部分是否之前被FDA审核批复过;
如果有,提供包含这些带点部分的递交号码(K号)
如有没有,需要提供包含IEC 60601-1以及IEC 60601-1-2的测试报告。
4.试剂稳定性
试剂的稳定性测试是否完成;
如果完成,提供完成的测试方案和报告;
如果未完成,提供试剂稳定性测试的测试方案,测试标准根据CLSI EP25来进行。
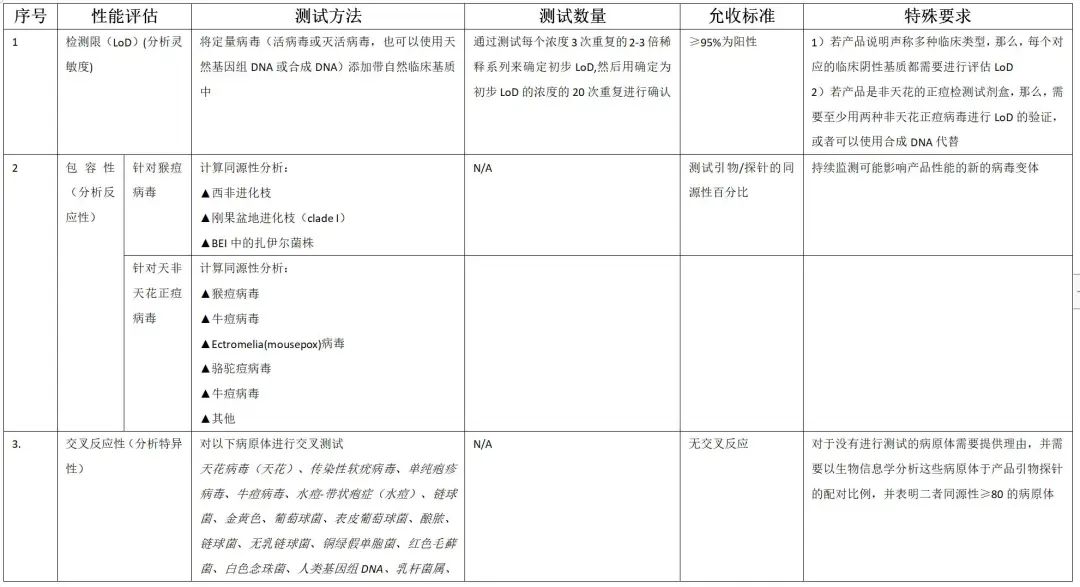
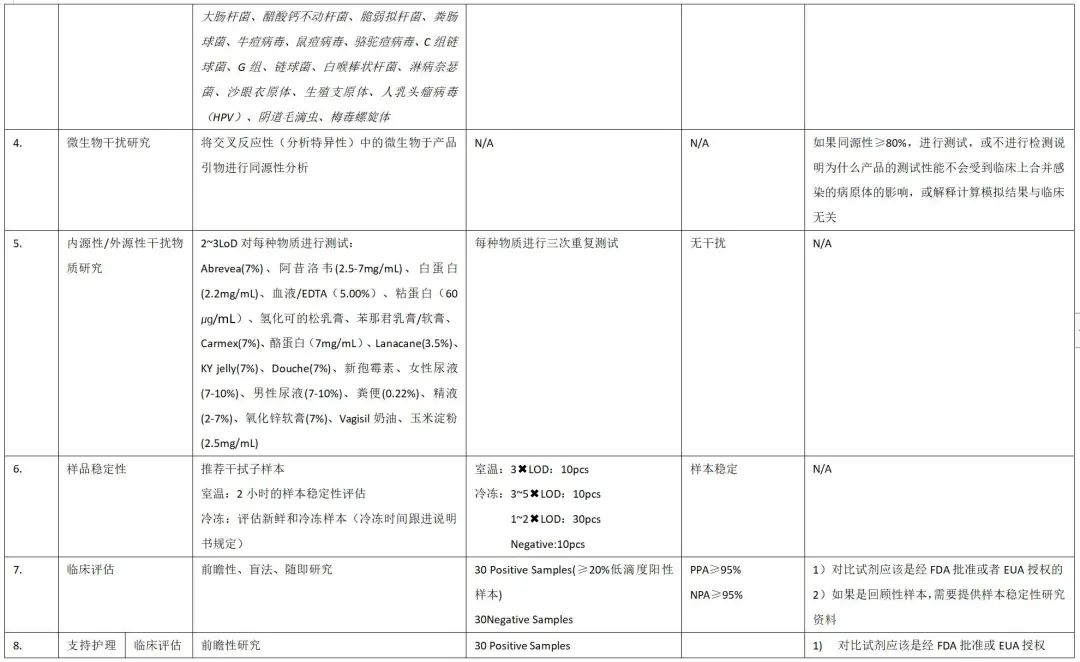
性能评估